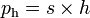1.vania 2.eka 3.fhara
hello
Jumat, 02 Mei 2014
Rabu, 23 April 2014
Menentukan Tetapan Kesetimbangan ( Kc )
Tetapan kesetimbangan adalah hasil kali konsentrasi setimbang zat di ruas kanan
dibagi hasil kali konsentrasisetimbang zat di ruas kiri, masing-masing konsentrasi zat dipangkatkan dengan koefisien reaksinya.

Persamaan tetapan kesetimbangannya adalah :

Tetapan kesetimbangan untuk reaksi yang sama "harganya tetap untuk suhu yang tetap"
zat padat murni ( s ) dan zat cair murni ( l ) TIDAK disertakan dalam penyusunan tetapan kesetimbangan

BiOCl (s) dan H2O tidak disertakan dalam persamaan Kc karena bertutut-turut bentuknya zat padat (s) dan zat cair murni ( l ).
Contoh Soal 1 :
Metana (CH4) dapat diperoleh dari dari reaksi gas CO2 dan gas H2 menurut persamaan :
Reaksi ini berlangsung pada suhu tinggi dengan suatu katalisator. Ke dalam ruangan 500 ml mula-mula dimasukkan 1 mol gas CO dan 3 mol gas H2 diperoleh 0,387 mol air. Tentukan besarnya tetapan kesetimbangannya pada suhu tersebut !
Jawab :
Mula-mula kalian buat bagan seperti di bawah ini :
angka yang dipakai untuk menyusun Kc adalah angka saat keadaan setimbang... tetapi ingat, bukan dalam mol namun dalam konsentrasi ( M )

karena volemenya 500 ml = 0,5 liter maka setiap molnya dibagi 0,5 :
CO = 0,622 mol / 0,5 l = 1,244 M
H2 = 1,866 mol/ 0,5 l = 3,732 M
CH4 = H2O = 0,378 mol / 0,5 l = 0,756 M
Harga Kc yang kecil menunjukkan reaksi ini hanya membentuk sedikit sekali metana (CH4)
Contoh Soal 2 :
Harga Kc untuk reaksi di bawah ini dalam suhu tertentu adalah 49

Pada suatu percobaan, 2 mol H , 2 mol I dan 4 mol HI dicampur dalam suatu ruangan 1 liter pada suhu yang sama. Tentukan mol HI saat mencapai keadaan setimbang !
Jawab :
Misalkan H yang bereaksi x mol maka :
Pada saat setimbang :

karena volumenya 1 liter maka mol = konsentrasinya ( ingat : M = mol/volume )

kedua ruas diakar :
14 - 7x = 4 + 2x
10 = 9x
x = 10/9 = 1,11
maka saat setimbang mol HI = (4 + 2x) = 6,22 mol
Contoh Soal 3 :
Dalam bejana 1 dm3 terdapat kesetimbangan antara 0,05 mol N2; 0,20 mol H2; dan 0,10 NH3. Untuk meningkatkan jumlah NH3 menjadi 0,20 mol dalam suhu dan volume tetap harus ditambahkan N2 sebanyak....
Jawab :

karena dalam suhu yang sama Kc tidak berubah maka berlaku Kc1 = Kc2
Ingat.... mol tiap-tiap senyawa tidak dibagi volume karena volumenya = 1 liter jika tidak satu liter maka mol tiap-tiap senyawa harus dibagi dengan volumenya seperti contoh soal no 1.
N2 = 4.0,05 = 0,20 mol
maka N yang ditambahkan = mol N setelah - mol N mula-mula = 0,20 mol - 0,05 mol = 0,15 mol
Perkembangan Teori Atom
Pengembangan konsep atom-atom secara ilmiah dimulai oleh John Dalton (1805), kemudian dilanjutkan oleh Thomson (1897), Rutherford (1911) dan disempurnakan oleh Bohr (1914). Setelah model atom Bohr, Heisenberg mengajukan model atom yang lebih dikenal dengan model atom mekanika gelombang atau model atom modern.
Model Atom Dalton
Pada tahun 1803, John Dalton mengemukakan pendapatnya
tentang atom. Teori atom Dalton didasarkan pada dua hukum, yaitu hukum
kekekalan massa (hukum Lavoisier) dan hukum susunan tetap (hukum
prouts).
Lavosier menyatakan bahwa :
"Massa total zat-zat sebelum reaksi akan selalu sama dengan massa total zat-zat hasil reaksi"
Sedangkan Prouts menyatakan bahwa :
"Perbandingan massa unsur-unsur dalam suatu senyawa selalu tetap"
Dari kedua hukum tersebut Dalton mengemukakan pendapatnya tentang atom sebagai berikut:
Pendahuluan Asam Basa
Dalam kesempatan ini pembahasan materi asam basa ditekankan pada aspek teoritik untuk tingkah laku asam dan basa. Teori asam basa sebagaimana umumnya terus berkembang untuk menjawab tantangan berkaitan dengan teori-teori yang lebih awal. Teori asam basa yang paling sederhana pada awalnya dikemukakan oleh Svante Arrhenius pada tahun 1884. Menurut teori Arrhenius, asam adalah spesies yang mengandung ion-ion hidrogen, H+ atau H3O+, dan basa mengandung ion hidroksida (OH-). Namun demikian, dalam teori ini terdapat dua kelemahan utama yang menyangkut masalah pelarut dan masalah garam.Teori asam basa Arrhenius ini berasumsi bahwa pelarut tidak berpengaruh pada sifat asam basa. Jika hidrogen klorida, HCl, dilarutkan dalam air untuk menghasilkan asam hidroklorida, larutan ini menghantarkan listrik, tetapi jika dilarutkan dalam pelarut seperti benzena, C6H6, larutannya tidak menghantarkan arus listrik. Perbedaan sifat HCl di dalam pelarut tersebut menyarankan bahwa pelarut benar-benar berpengaruh terhadap tingkah laku zat terlarut.
Masalah kedua menyangkut tingkah laku garam. Garam seharusnya bersifat sebagai spesies netral, namun kenyataannya banyak garam yang bersifat tidak netral, jadi bertentangan dengan anggapan ini. Sebagai contoh, larutan ion fosfat dan karbonat bersifat basa, sebaliknya ion-ion amonium bersifat sedikit asam dan ion-ion aluminium bersifat sangat asam. Masalah yang menambah kebingungan ditunjukkan dengan oleh larutan NaH2PO4 yang bersifat basa.
Untuk mengatasi masalah tersebut dan juga agar lebih realistik, pada tahun 1923 Thomas M. Lowry dari Inggris dan Johannes N. Brønsted dari Denmark, masing-masing bekerja sendiri-sendiri melengkapi teori asam basa yang melibatkan pelarut yang kemudian dikenal dengan teori asam basa Brønsted-Lowry. Pemahaman asam basa yang melibatkan aspek donor-akseptor elektron dikenalkan oleh G. N. Lewis pada tahun yang sama dan ion oksida oleh H. Lux (1939) dan H. Flood (1947). Perlu dicatat bahwa pengertian asam basa bukan berbicara tentang aspek kebenaran melainkan aspek kesesuaian pada kondisi tertentu.
Teori Asam Basa
Dari keseluruhan teori asam basa, maka dapat disimpulkan sebagai berikut.Teori Asam Basa Arrhenius
Teori asam basa Arrhenius didasarkan pada pembentukan ion dan pada larutan berair (aqueous solution).- Asam adalah spesies yang menghasilkan ion H+ atau H3O+ dalam larutan berair.
- Basa adalah spesies yang menghasilkan ion OH- dalam larutan berair.
Teori Asam Basa Lewis
Teori asam basa Lewis didasarkan pada transfer pasangan elektron.- Asam adalah spesies penerima (akseptor) pasangan elektron.
- Basa adalah spesies pemberi (donor) pasangan elektron.
Teori Asam Basa Brønsted-Lowry
Teori asam basa Brønsted-Lowry didasarkan pada transfer proton.- Asam adalah spesies pemberi (donor) proton.
- Basa adalah spesies penerima (akseptor) proton.
Sifat-sifat Asam Basa
Sifat Asam
- Mempunyai rasa asam (awas jangan sekali-sekali mencicipinya!). Kata asam berasal dari bahasa Latin acere yang berarti asam.
- Mengubah lakmus dari warna biru ke merah.
- Larutan asam menghantarkan arus listrik (bersifat elektrolit).
- Bereaksi dengan basa membentuk garam dan air.
- Menghasilkan gas hidrogen ketika bereaksi dengan logam (seperti logam alkali, alkali tanah, seng, aluminium).
Sifat Basa
- Mempunyai rasa pahit (awas jangan sekali-sekali mencicipinya!).
- Terasa licin atau bersabun (awas jangan secara langsung menyentuhnya!).
- Mengubah lakmus dari warna merah ke biru.
- Larutan basa menghantarkan arus listrik (bersifat elektrolit).
- Bereaksi dengan asam membentuk garam dan air.
Contoh Asam Basa
Contoh asam dalam kehidupan sehari-hari:
- Vitamin C (asam askorbat)
- Asam cuka (mengandung sekitar 5% asam asetat)
- Asam karbonat (terdapat pada minuman ringan)
Contoh basa dalam kehidupan sehari-hari:
- Deterjen
- Sabun
- Amonia rumah tangga
Langganan:
Komentar (Atom)